Mostrar el registro sencillo del ítem
dc.contributor.author
Alvarez, Yanina Daniela

dc.contributor.author
Fauerbach, Jonathan Arturo

dc.contributor.author
Pellegrotti, Jesica Vanesa

dc.contributor.author
Jovin, Thomas
dc.contributor.author
Jares, Elizabeth Andrea

dc.contributor.author
Stefani, Fernando Daniel

dc.date.available
2015-12-21T14:11:56Z
dc.date.issued
2013-11
dc.identifier.citation
Alvarez, Yanina Daniela; Fauerbach, Jonathan Arturo; Pellegrotti, Jesica Vanesa; Jovin, Thomas; Jares, Elizabeth Andrea; et al.; Influence of Gold Nanoparticles on the Kinetics of α-Synuclein Aggregation; American Chemical Society; Nano Letters; 13; 12; 11-2013; 6156-6163
dc.identifier.issn
1530-6984
dc.identifier.uri
http://hdl.handle.net/11336/3081
dc.description.abstract
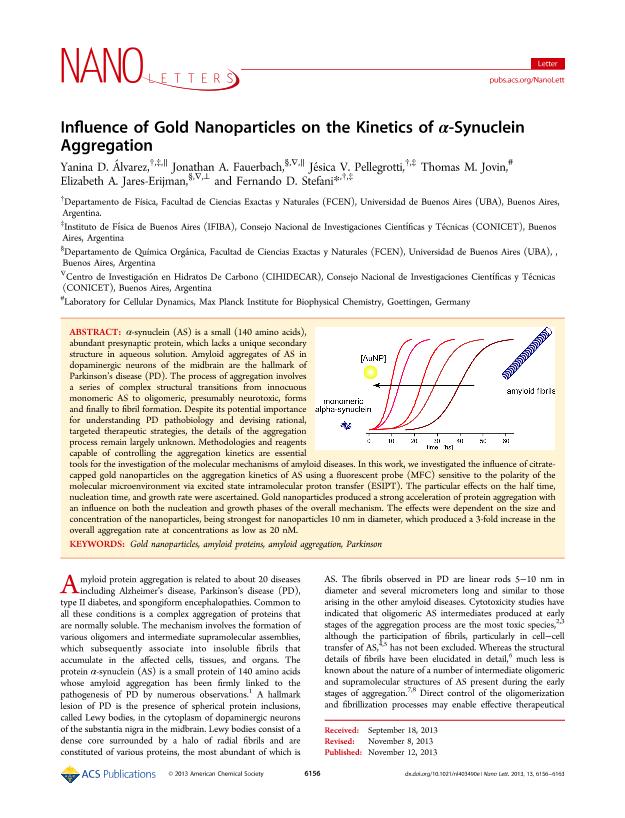
α-synuclein (AS) is a small (140 amino acids), abundant presynaptic protein, which lacks a unique secondary structure in aqueous solution. Amyloid aggregates of AS in dopaminergic neurons of the midbrain are the hallmark of Parkinson's disease (PD). The process of aggregation involves a series of complex structural transitions from innocuous monomeric AS to oligomeric, presumably neurotoxic, forms and finally to fibril formation. Despite its potential importance for understanding PD pathobiology and devising rational, targeted therapeutic strategies, the details of the aggregation process remain largely unknown. Methodologies and reagents capable of controlling the aggregation kinetics are essential tools for the investigation of the molecular mechanisms of amyloid diseases. In this work, we investigated the influence of citrate-capped gold nanoparticles on the aggregation kinetics of AS using a fluorescent probe (MFC) sensitive to the polarity of the molecular microenvironment via excited state intramolecular proton transfer (ESIPT). The particular effects on the half time, nucleation time, and growth rate were ascertained. Gold nanoparticles produced a strong acceleration of protein aggregation with an influence on both the nucleation and growth phases of the overall mechanism. The effects were dependent on the size and concentration of the nanoparticles, being strongest for nanoparticles 10 nm in diameter, which produced a 3-fold increase in the overall aggregation rate at concentrations as low as 20 nM.
dc.format
application/pdf
dc.language.iso
eng
dc.publisher
American Chemical Society

dc.rights
info:eu-repo/semantics/openAccess
dc.rights.uri
https://creativecommons.org/licenses/by-nc-sa/2.5/ar/
dc.subject
Gold Nanoparticles
dc.subject
Amyloid Proteins
dc.subject
Amyloid Aggregation
dc.subject
Parkinson
dc.subject.classification
Física Atómica, Molecular y Química

dc.subject.classification
Ciencias Físicas

dc.subject.classification
CIENCIAS NATURALES Y EXACTAS

dc.title
Influence of Gold Nanoparticles on the Kinetics of α-Synuclein Aggregation
dc.type
info:eu-repo/semantics/article
dc.type
info:ar-repo/semantics/artículo
dc.type
info:eu-repo/semantics/publishedVersion
dc.date.updated
2016-03-30 10:35:44.97925-03
dc.journal.volume
13
dc.journal.number
12
dc.journal.pagination
6156-6163
dc.journal.pais
Estados Unidos

dc.journal.ciudad
Washington
dc.description.fil
Fil: Alvarez, Yanina Daniela. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Departamento de Física; Argentina. Consejo Nacional de Investigaciones Científicas y Técnicas. Oficina de Coordinación Administrativa Ciudad Universitaria. Instituto de Física de Buenos Aires; Argentina
dc.description.fil
Fil: Fauerbach, Jonathan Arturo. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Departamento de Química Orgánica; Argentina. Consejo Nacional de Investigaciones Científicas y Técnicas. Oficina de Coordinación Administrativa Ciudad Universitaria. Centro de Investigaciones en Hidratos de Carbono; Argentina
dc.description.fil
Fil: Pellegrotti, Jesica Vanesa. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Departamento de Física; Argentina. Consejo Nacional de Investigaciones Científicas y Técnicas. Oficina de Coordinación Administrativa Ciudad Universitaria. Instituto de Física de Buenos Aires; Argentina
dc.description.fil
Fil: Jovin, Thomas. Max Planck Institute for Biophysical Chemistry. Laboratory for Cellular Dynamics; Alemania
dc.description.fil
Fil: Jares, Elizabeth Andrea. Consejo Nacional de Investigaciones Científicas y Técnicas. Oficina de Coordinación Administrativa Ciudad Universitaria. Centro de Investigaciones en Hidratos de Carbono; Argentina. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Departamento de Química Orgánica; Argentina
dc.description.fil
Fil: Stefani, Fernando Daniel. Consejo Nacional de Investigaciones Científicas y Técnicas. Oficina de Coordinación Administrativa Parque Centenario. Centro de Investigaciones en Bionanociencias "Elizabeth Jares Erijman"; Argentina. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Departamento de Física; Argentina. Consejo Nacional de Investigaciones Científicas y Técnicas. Oficina de Coordinación Administrativa Ciudad Universitaria. Instituto de Física de Buenos Aires; Argentina
dc.journal.title
Nano Letters

dc.relation.alternativeid
info:eu-repo/semantics/altIdentifier/issn/1530-6984
dc.relation.alternativeid
info:eu-repo/semantics/altIdentifier/doi/http://dx.doi.org/10.1021/nl403490e
dc.relation.alternativeid
info:eu-repo/semantics/altIdentifier/url/http://pubs.acs.org/doi/abs/10.1021/nl403490e
Archivos asociados